【来源:虎嗅网】
本文来自微信公众号:返朴 (ID:fanpu2019),作者:顾舒晨
在电子科技飞速发展的今天,共享充电宝已成为我们日常生活中不可或缺的工具。但你是否想过,在我们身体的细胞中,也存在着类似的“共享供电”现象?科学家发现,线粒体——这个被称为细胞“能量工厂”的重要细胞器,竟然能够在不同细胞之间转移。这一功能不仅能够帮助机体修复损伤、对抗疾病,甚至还能被癌细胞利用来“偷电”求生。随着研究的深入,线粒体转移已成为当今生物学研究的热点之一。
线粒体研究:从“独享”到“共享”的进化
线粒体是真核细胞内负责产生能量的细胞器,能为细胞提供约90%的能量需求,因此被誉为细胞的“能量工厂”。除此之外,它还参与活性氧生成、氧化还原电位维持、信号转导等重要生理功能。自19世纪中期被发现以来,线粒体长期被认为是细胞内固定的“私有财产”,只能通过细胞分裂传递给后代(垂直传递);也就是说,遗传信息只能从亲代传递给子代,而无法在不同个体之间转移。然而,2006年科学家Jeffrey Spees团队首次观察到:具有线粒体DNA缺陷的细胞(无法自主产能)能够通过接收健康线粒体恢复活力[1]。这一突破性发现彻底改变了我们对线粒体的传统认知。
如今,“线粒体转移”现象已在多种生物中被证实,例如酵母、软体动物以及啮齿动物等[2]。虽然科学家尚未完全揭示促使线粒体移动的具体机制,但研究表明,细胞可能会在必要时将自己的线粒体“借给”邻近细胞,以帮助机体启动组织修复或激活免疫系统[3]。然而,以目前的技术还无法在人体内实时观测到“线粒体转移”这个过程,也正因为如此,这种共享线粒体对人类健康的作用也依然是个谜。不过,科学家已经开始利用这个能力,开发一些治疗手段以尝试治疗包括癌症在内的多种疾病。
线粒体如何“快递”到其他细胞?
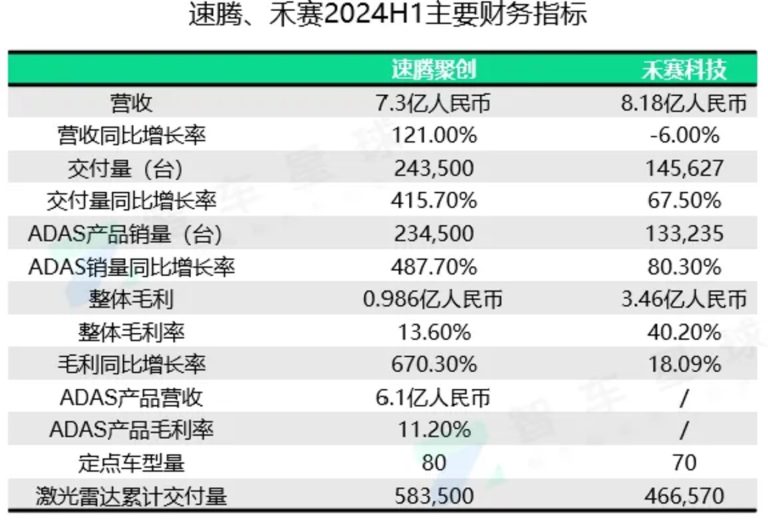
尽管线粒体转移的具体机制目前还未完全明确,但生物学家已经发现了三种主要的“物流系统”,包括:纳米管道(Tunnel nanotube,TNT)、细胞外囊泡(extracellular vesicle,EVs)和直接释放游离线粒体供受体细胞捕获[3]。
图1 线粒体转移机制。图源:参考文献[3]
纳米管道——细胞间的高速公路
纳米管道是目前最为广泛报道的一种线粒体转移的方式。2008年,首次有研究者从电镜下观测到骨髓干细胞可以通过形成纳米管道直接与其他细胞进行连接(如图1中A),并且能够通过这个结构向其他细胞转移线粒体[4]。
许多研究表明这种纳米管道的宽度大部分在50-70nm之间,长度可达到数微米,可以双向传输线粒体、内质网、钙离子等多种细胞内物质[5]。目前,这种线粒体转移的方式在许多体外实验和动物损伤模型中都得以证实,例如在心血管系统、免疫系统、呼吸系统、角膜上皮细胞、肿瘤以及中枢神经系统中都发现了这样的传递[3]。但鉴于纳米管道能够共享多种细胞成分,因此证实所观察到的表型是否与细胞间线粒体交换相关仍然是一个科学挑战。
细胞外囊泡——线粒体的“快递包裹”
另一种常见的细胞间线粒体转移机制类似发快递:释放和捕获含有线粒体的细胞外囊泡作为货物(如图1中B)。细胞外囊泡是细胞脱落或者释放的膜性小泡,是细胞间主动交流的一种手段。细胞外囊泡可以根据大小及其线粒体货物进行分类,将线粒体放入合适的“包装盒”。健康的线粒体通常为长1~2μm,宽0.5~1μm的柱状体,但它的大小并非一成不变,在疾病的情况下线粒体形态通常会发生变化,目前在细胞外囊泡中发现的线粒体也有着不同的大小。例如在白色脂肪细胞和棕色脂肪细胞中发现的细胞外囊泡的宽度大约为100-200nm,通常含有氧化损伤的线粒体成分[6,7]。但在心肌细胞研究中发现的细胞外囊泡大小约为300-600nm宽,内含受损的线粒体[8]。虽然大多数报告表明细胞外囊泡中含有的线粒体受到损害,但也有一些报告表明,完整的、功能性的线粒体可以从细胞中释放到大约1μm宽的细胞外囊泡中;这些细胞外囊泡也可以是多囊泡体从质膜上通过出芽的方式从细胞中释放。例如神经干细胞释放的细胞外囊泡中就含有完整且有功能的线粒体[9]。
尽管细胞外囊泡中线粒体的转移机制已被广泛研究,但仍有许多问题待解决,例如细胞外囊泡如何精确地与靶细胞对接,它们被靶细胞内化后的处理过程,以及它们如何在细胞内定位和发挥作用,等等。
直接释放游离线粒体——血液中的“能量漂流瓶”
第三种主要的释放机制是将线粒体直接释放出细胞外,然后被受体细胞捕获(如图1中C)。这种形式最早是在小鼠和人类的血液中发现的,其中一个来源是活化的血小板会释放游离的线粒体[10]:游离线粒体宽度约为0.5-1μm,能够检测到线粒体外膜标志物。但与细胞外囊泡的传递有所区别的是,这种方式并没有给这些线粒体货物进行包装,因此我们并不能检测到细胞外囊泡标志物;电子显微照片也显示这种游离线粒体并不含有外膜。不过,血液中游离线粒体的细胞来源可能不止血小板一种,它可以是多种多样的。被受体细胞捕获后,裸露线粒体的命运也尚不清楚。
线粒体转移的利与弊
目前线粒体如何转移在很大程度上已得到解决,但我们依然不太清楚的是什么促使了线粒体的转移,以及线粒体的转移到底是敌是友,抑或本身就是双重作用?
有一些研究表明,线粒体转移能够帮助损伤的细胞进行恢复。2016年,KazuhideHayakawa及其同事发现线粒体转移可能有助于细胞抵御神经风暴[11]。在中风的小鼠中,星形胶质细胞的支持细胞会将其线粒体输送给衰弱的神经元。有了这种线粒体的助力,神经元能够重新长出分支并启动代谢过程,从而提高了它们的存活几率。当研究人员抑制线粒体转移时,存活的神经元减少,这表明捐赠的细胞器是细胞恢复的关键。但线粒体是如何保护细胞的仍不清楚。在急性损伤性肺炎小鼠实验中,人们也观察到结缔组织的基质细胞能够将线粒体转移到肺细胞,帮助肺炎的修复[12]。此外,血小板释放的线粒体能够被干细胞接收从而促进血管新生,促进伤口的修复[9]。
但也有证据显示,线粒体并不是完全的雪中送炭,有的时候也会干一些火上浇油的事儿。几项研究表明,癌细胞可以从体内其他细胞窃取线粒体[13]。从这种负面行为来看,线粒体转移似乎有助于癌细胞逃避免疫系统,变得更具侵袭性并且对治疗更有抵抗力。2025年初发表在Nature杂志的一篇研究还发现,乳腺癌细胞能够向T细胞投递功能失调的线粒体,从而抑制机体的免疫防御机制,促进癌细胞的免疫逃逸[14]。另外,白血病细胞也能够通过获取骨髓细胞的线粒体以抵抗化疗[15]。还有研究表明,癌细胞从其他细胞吸收线粒体后增殖得更快[15]。
医学应用的曙光与挑战
虽然目前我们只在体外实验中证实了线粒体转移的存在,但也有迹象显示在体内也存在着这一现象。例如有研究就在癌症患者的免疫细胞中发现了含有癌细胞突变基因的线粒体,而这些线粒体似乎阻碍了免疫细胞对癌细胞的攻击[14]。如果线粒体转移最终被证实也是体内的一个重要的生物学过程,那它也可能存在着无限的治疗潜力。
事实上,已经有研究人员尝试将健康的线粒体直接移植到患病细胞中,以治疗与线粒体功能障碍相关的疾病,例如利氏综合征——一种罕见的遗传疾病(在这种疾病中,神经细胞的死亡会导致癫痫发作和发育迟缓),也包括心脏病和中风[16]。同时,研究人员已经开始开发利用人体自身线粒体转移能力的治疗方法,利用这一过程增强当前的T细胞疗法——这种疗法利用人体自身的免疫细胞来对抗癌症。2024年的一项研究证实,在培养皿中共同培养基质细胞和T细胞,基质细胞会将其线粒体输送给T细胞,以提高T细胞的代谢适应性[17]。这些增强的T细胞比没有接受线粒体捐赠的T细胞更有效地侵入小鼠的肿瘤,并且显示出更少的衰竭迹象。此外,也有研究者针对如何诱导细胞捐赠线粒体进行研究。
但任何治疗能够进入临床之前都必须得到全面的了解,研究人员也必须更好地了解线粒体转移,查明其具体的机制后才能够开发更多的方法研究和追踪线粒体,以了解其治疗的能力和可能的危害。如何精准控制线粒体的来源、数量和靶向性,异体线粒体是否引发排斥等都是急需解决的问题。
线粒体转移现象的发现,揭示了细胞间存在远超想象的复杂互助网络——从代谢支援到免疫协作,甚至跨器官对话。这不仅刷新了基础生物学认知,更为癌症、代谢病、神经退行性疾病等治疗提供了全新思路。“线粒体增强疗法”是否会像输血一样普遍,让我们拭目以待!
参考文献
[1]Spees JL et al.Mitochondrial transfer between cells can rescue aerobic respiration.Proceedings of the National Academy of Sciences 103,1283–1288,doi:10.1073/pnas.0510511103(2006).
[2]Monzel AS et al.Multifaceted mitochondria:moving mitochondrial science beyond function and dysfunction.Nature Metabolism 5,546–562,doi:10.1038/s42255-023-00783-1(2023).
[3]Borcherding N,Brestoff JR.The power and potential of mitochondria transfer.Nature.2023 Nov;623(7986):283-291.doi:10.1038/s41586-023-06537-z.
[4]Plotnikov EY et al.Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture.Journal of Cellular and Molecular Medicine 12,1622–1631,doi:10.1111/j.1582-4934.2007.00205.x(2008)
[5]Rustom A et al.Nanotubular highways for intercellular organelle transport.Science.2004 Feb 13;303(5660):1007-10.doi:10.1126/science.1093133.
[6]Crewe C et al.Extracellular vesicle-based interorgan transport of mitochondria from energetically stressed adipocytes.Cell Metabolism 33,1853–1868.e1811,doi:10.1016/j.cmet.2021.08.002(2021).
[7]Rosina M et al.Ejection of damaged mitochondria and their removal by macrophages ensure efficient thermogenesis in brown adipose tissue.Cell Metabolism 34,533–548.e512,doi:10.1016/j.cmet.2022.02.016(2022).
[8]Wenjing L et al.The Small GTPase Rab7 Regulates Release of Mitochondria in Extracellular Vesicles in Response to Lysosomal Dysfunction.bioRxiv,2023.2002.2011.528148,doi:10.1101/2023.02.11.528148(2023).
[9]Boudreau LH et al.Platelets release mitochondria serving as substrate for bactericidal group IIA-secreted phospholipase A2 to promote inflammation.Blood 124,2173–2183,doi:10.1182/blood-2014-05-573543(2014).
[10]Dache ZAA et al.Blood contains circulating cell-free respiratory competent mitochondria.The FASEB Journal 34,3616–3630,doi:10.1096/fj.201901917RR(2020).
[11]Hayakawa K,Esposito E,Wang X,Terasaki Y,Liu Y,Xing C,Ji X,Lo EH.Transfer of mitochondria from astrocytes to neurons after stroke.Nature.2016 Jul 28;535(7613):551-5.doi:10.1038/nature18928.
[12]Islam MN et al.Mitochondrial transfer from bone-marrow–derived stromal cells to pulmonary alveoli protects against acute lung injury.Nat Med 18,759–765,doi:10.1038/nm.2736(2012).
[13]Saha T et al.Intercellular nanotubes mediate mitochondrial trafficking between cancer and immune cells.Nature Nanotechnology 17,98–106,doi:10.1038/s41565-021-01000-4(2022).
[14]Ikeda,H.et al.Immune evasion through mitochondrial transfer in the tumour microenvironment.Nature.2025.doi:10.1038/s41586-024-08439-0
[15]Marlein CR et al.NADPH oxidase-2 derived superoxide drives mitochondrial transfer from bone marrow stromal cells to leukemic blasts.Blood 130,1649–1660,doi:10.1182/blood-2017-03-772939(2017).
[16]Herbert M&Turnbull D Progress in mitochondrial replacement therapies.Nature Reviews Molecular Cell Biology 19,71–72,doi:10.1038/nrm.2018.3(2018).
[17]Baldwin JG et al.Intercellular nanotube-mediated mitochondrial transfer enhances T cell metabolic fitness and antitumor efficacy.Cell.2024 Nov 14;187(23):6614-6630.e21.doi:10.1016/j.cell.2024.08.029.